|
|||||||||||||||||||||||||||||||||||||||||||||
![]()
|
ATOMES & Nucléons dans l’Univers L'atome est composé
d'un noyau formé de nucléons: neutrons et protons; et, d'électrons
qui "tournent" très loin de ce noyau. Il y aurait: 10 80 nucléons dans l'Univers
visible. Une quantité, somme
toute, pas
si grande! |
|
En 1803, John
Dalton (1766-1844) propose sa théorie atomique:
la matière est composée d'atomes de masses différentes qui se combinent selon
des proportions simples. Dalton admettait que les gaz sont formés de petites
particules qui sont toujours en mouvement. Les particules, ou atomes, d'un corps simple sont semblables entre elles. En 1913, le
physicien danois Niels Bohr (1885-1962) imagine un modèle
planétaire de l’atome afin d’expliquer les raies émises par des atomes d’hydrogène
excités. Ce modèle, est vite dépassé car il ne permet pas d’expliquer les
spectres des autresatomes. L'électron devient un paquet d'ondes probables et la
physique de l'atome devient physique
quantique. |
|
|
|
|
Un million
d'atomes tiendraient dans l'épaisseur d'un cheveu. Il a 2
milliards d'atomes dans ce point, juste là "." Si l'atome était un stade, le noyau serait une tête
d'épingle au centre et les électrons seraient à la place des spectateurs, chacun ayant la taille d'un
grain de poussière !
Modèle antique
|
|
Voir Atomes – Index
|
Deux
atomistes: Leucippe (mort vers -420) et son élève Démocrite morts vers -370).
Aucun écrit connus. Athéistes, la connaissance du monde doit être basée sur
l'observation et le raisonnement à l'exception de tout mysticisme. Un
morceau de matière (de bois, par exemple) peut être coupé en morceaux et, ces
morceaux coupés à leur tour et ainsi de suite. Juste qu'à ce que cela
devienne impossible physiquement. Mais l'opération peut être prolongée par la
pensée. Mais là aussi, il faudra bien s'arrêter. Il existe donc bien des
morceaux de matières insécables et de même nature que la matière initiale. Mais
physiciens de l'époque pensaient au contraire que toute chose était faite à
partir de quatre constituants
de base. |
|
|
|
|
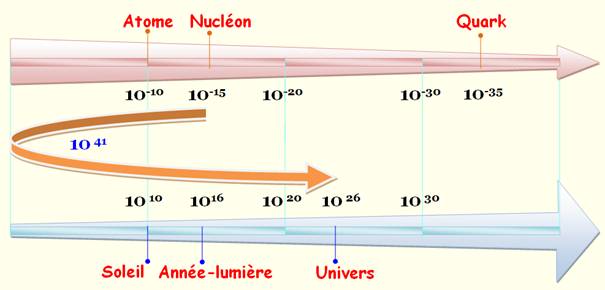
Diamètre
d'un atome moyen 1
angström
= 0,1 nanomètre = 10-10 m Du plus petit au plus grand de 0,43
Hydrogène H (1) à 2,
6 Césium Cs (55) Voir Tableau complet
Diamètre
d'un nucléon: proton ou neutron 1
fermi
= 1 femtomètre = 10-15 m
Comparaison: distance
en mètres
|
|
|
|
|||||||||||||||||||||||||
|
ATOME
SYSTÈME
SOLAIRE
Comparaison
|
|||||||||||||||||||||||||
|
|
|
|
Voir Nombre de masse, masse
atomique / Isotopes / Ions |
|
|
|
|
|
Sur la base de
telles idées, les physiciens arrivent à ralentir les atomes à des vitesses de
l'ordre de quelques centimètres par seconde (Claude Cohen-Tannoudji, français
– Prix Nobel 1997). Dans ce monde, ralentir,
c'est refroidir: les atomes descendent à quelques millionièmes
de degré au-dessus du zéro
absolu. Source:
Pour la Science – Fév. 2009 – Enrouler la lumière pour piéger les atomes. |
|
Voir Nombre 400
|
|
||
|
10 78 < N
< 10 80 Voir Noyaux dans l'univers et Eddington
Quantité
de nucléons - Exemples |
||
|
Nombres d'atomes |
Dans |
|
|
10 80 |
||
|
10 57 |
|
|
|
10 50 |
|
|
|
2 10 30 |
||
|
6,5 10 27 |
|
|
|
5 10 25 |
|
|
|
4 10 24 |
|
|
|
> 10 24 |
|
|
|
0,67 10 24 |
||
|
6 10 23 |
|
|
|
3 10 27 |
|
|
|
7 10 27 |
|
|
|
10 19 |
|
|
|
10 10 |
|
|
|
< 10 |
|
|
|
|
|||
|
Caractéristiques |
Valeur |
Unités |
|
|
|
6 10 27 |
g |
|
|
|
1,66 10 -24 |
g |
|
|
|
< 3,6 10 51 |
atomes sur Terre |
|
|
|
10 50 |
|
|
|
|
||||
|
Caractéristiques |
Min |
Max |
Unités |
|
|
|
3 |
6 |
atomes / m3 |
|
|
|
12 |
15 |
milliards d’années-lumière |
|
|
|
0, 946 |
|
10 16 m |
|
|
|
1,135 |
1,42 |
10 26 m |
|
|
|
1,837 |
3,590 |
10 79 m3 |
|
|
|
5,5 |
32,4 |
10 79 |
|
|
|
1 |
1 |
10 11 |
|
|
|
1 |
1 |
10 11 |
|
|
|
5,5 |
32,4 |
10 57 |
|
|
Calcul à partir de l'atome |
||||
|
|
2 |
1033 g |
||
|
|
0,5 |
1024 |
||
|
|
1057 |
|||
|
Notes: En fait les
scientifiques calculent à l’envers. À partir du nombre estimé d’atomes dans
le Soleil. Le nombre moyen
d'atomes dans l'univers met en jeu la densité critique de l'Univers, Constante
de Hubble, Théorie d'Einstein … Voir Sites spécialisés sur ce sujet Mots clés: Density of the
Universe, critical density of matter, critical mass density. |
|
|
||
|
10 79 |
m3 |
|
|
10 88 |
mm3 |
|
|
10 97 |
|
|
|
10 106 |
nm3 nano
= 10-9 La
lumière parcourt 30 cm en 1 ns |
|
|
10 109 |
unité
atome (10-10 m) * |
|
|
10 124 |
unité
neutrons (10-15 m) * |
|
|
10 133 |
unité
quarks (10-18 m) * |
|
|
Volume de l’univers * en supposant que
ces objets soient empilés. Ce qui n’est bien sûr pas le cas. L’exposant reste
dans le bas de la centaine. Ce ne sont pas de
grands nombres. |
||
Voir Puissances de dix / Taille de l'Univers
![]()
|
Suite |
|
|
Voir |
|
|
DicoNombre |
|
|
Sites |
|
|
Cette page |
![]()