|
|||||||||||||||||||||||||||||||||||||||||||||
![]()
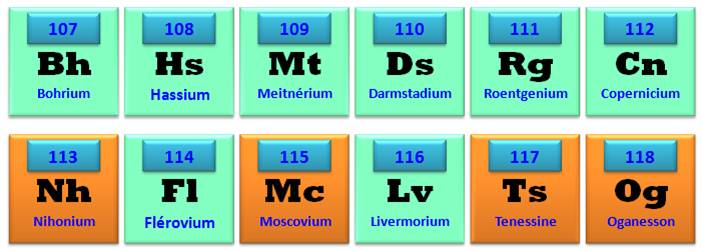
Les quatre
nouveaux éléments introduits dans la table périodique en 2016
(en ocre)
Voir Historique des
découvertes >>>
![]()
|
ÉLÉMENTS CHIMIQUES ou CORPS SIMPLES Sur
la centaine d'éléments chimique
naturels seuls 27 se trouvent dans la matière vivante et 4 d'entre eux (carbone, hydrogène, oxygène et
azote) Les
éléments sont des corps chimiques de base de l'Univers.
Les
records
|
|
Élément chimique ou élément |
Atomes ayant le même nombre de protons dans leur noyau
atomique. Ce nombre (Z) est le numéro
atomique de l'élément. |
|
|
Corps simple |
Substance
pure constituée d'atomes du même élément. |
Le gaz oxygène: dioxygène (O2)
Le gaz ozone (O3) |
|
Corps composé |
Substance
qui peut être décomposé en d'autres éléments distincts. |
L'eau
(H2O) |
Voir
DicoCulture
|
|
|||||||||||||
|
Chaque molécule est formée d'un groupement
d'atomes. Molécule date de 1660 (Pierre Gassendi). Plus
petite unité d'une substance capable d'exister sous forme séparée. Les
molécules sont des assemblages d'atomes dixit Dalton (celui du daltonisme). John Dalton (1766-1844) est le créateur de la
théorie atomique. Il énonce la loi des proportions multiples en chimie, et
celle du mélange des gaz en physique.
70 % d'hydrogène - abondant 1 % d'oxygène - rare 1/ 1 000 000 d'eau - rarissime |
|||||||||||||
Les quatre
nouveaux (2016) en ocre

Tableau de repérage uniquement: Internet fournit de nombreux tableaux interactifs
Voir Principe d'exclusion
de Pauli / Rayon des atomes
![]()
|
Index alphabétique et liens vers ce site |
|
|||
|
1 à 19 |
20 à 39 |
> 40 |
Éléments |
|
|
|
|
89 |
|
|
|
13 |
|
|
||
|
|
|
51 |
||
|
|
|
47 |
||
|
18 |
|
|
||
|
|
33 |
|
|
|
|
|
|
85 |
Élément le
plus rare d'origine naturelle sur Terre. Pas plus de 30 grammes. Semi-métal
radioactif. |
|
|
7 |
|
|
||
|
|
|
48 |
|
|
|
|
55 |
|
|
|
20 |
|
|
|
6 |
|
|
|
|
17 |
|
|
|
|
|
24 |
|
|
|
|
27 |
|
|
|
|
29 |
|
|
|
|
57 à 71 |
|
|
3 |
|
|
|
|
|
|
71 |
|
|
12 |
|
|
|
|
|
25 |
|
|
|
|
|
80 |
|
|
|
|
42 |
|
|
|
|
88 |
|
|
|
|
86 |
|
|
|
|
75 |
|
|
|
|
45 |
|
|
|
37 |
|
|
|
|
|
44 |
|
|
|
> 107 |
Les sept métaux
sacrés
|
Les sept métaux sont
les métaux connus, et reconnus comme tels, de l'Antiquité jusqu'à la
Renaissance. Liste et
depuis quand sont-ils connus:
|
Voir Dates des inventions
|
|
||||
|
Avant 1700 |
1700-1799 |
1800-1849 |
1850-1899 |
|
|
Antimoine Argent Arsenic Carbone Cuivre Étain Fer Mercure Or Phosphore Plomb Soufre |
Azote Béryllium Bismuth Chlore Chrome Cobalt Fluor Hydrogène Manganèse Molybdène Nickel Oxygène Platine Strontium Tellure Titane Tungstène Uranium Yttrium Zinc Zirconium |
Aluminium Baryum Bore Brome Cadmium Calcium Cérium Erbium Iode Lanthane Iridium Lithium Magnésium Niobium Osmium Palladium Potassium Rubidium Sélénium Silicium Sodium Tantale Thorium Vanadium |
Actinium Argon Césium Dysprosium Gadolinium Gallium Germanium Hélium Holmium Indium Krypton Néodyme Néon Polonium Praséodyme Radium Rhodium Ruthénium Samarium Scandium Thallium Thulium Xénon Ytterbium |
|
|
12 |
21 |
24 |
24 |
|
|
|
||
|
1817 Johann Döbereiner |
Triades:
classement des éléments en famille de mêmes propriétés. Avec trois éléments
de masses successives pris dans une famille,
la masse de l'élément central est la demi-somme des deux autres. |
|
|
1859 Jean-Baptiste Dumas |
Tétrades:
les éléments partageant les mêmes propriétés chimiques présentent des écarts
constants entre leur masse. |
|
|
1862 Alexandre de Chancourtois |
Invente la
vis tellurique, un cylindre où les éléments chimiques sont inscrits en biais.
Les éléments chimiques de mêmes propriétés se retrouvent alignés
verticalement. |
|
|
1864 John Newlands |
Publie
une classification des éléments et émet la loi de l'octave: le huitième élément
qui suit un élément possède les mêmes propriétés que celui-ci. |
|
|
1869 Dmitri Mendeleïev (1834-1907) |
Publie:
La dépendance entre les propriétés des masses atomiques des éléments. En
bref: 1. Périodicité des éléments selon leur masse 2. Les éléments semblables ont soit des masses proches ou des masses en
augmentation constante. 3. La position dans la table correspond à sa valence
(capacité à se lier à plus ou moins d'atomes). 4. Les plus légers sont les plus nombreux dans la nature. Le lithium est
une exception. 5. La masse atomique détermine le caractère de l'élément. 6. Si une exception au rangement dans le tableau se présente, c'est qu'il
y a une erreur dans les mesures. 7. Les places vacantes correspondent à des éléments à découvrir. |
|
|
1870 Lothar Meyer |
Publie sa
classification des éléments en 1864, 1868 puis 1870, indépendamment de
Mendeleïev. Trop tard de quelques mois! Il n'a
cependant pas fait la prédiction d'éléments nouveaux comblant les places
libres de la classification. |
|
|
1864 William Odling |
Lui aussi
est au même point d'avancement bien avant Mendeleïev et Meyer. Il apporte
même des améliorations au tableau. Ses travaux n'ont pas été reconnus du fait
de sa réputation. Il avait critiqué les travaux de Newlands. |
|
![]()
|
Suite |
|
|
Voir |
|
Livre |
|
|
Sites Tableau |
|
|
Sites Chimie |
|
|
Cette page |
![]()

