|
|||||||||||||||||||||||||||||||||||||||||||||
![]()
|
CARBONE & produits carbonés
|
|
|
||
|
Variétés |
|
|
|
Diamant |
Voir Taille
(brillant) / Suite Diamant |
|
|
Graphite |
|
|
|
Charbon
amorphe |
|
|
|
Carbone
odorant |
ou fullerène
|
|
|
Composés |
Voir Oxydes
de carbone |
|
|
Abondance |
|
|
|
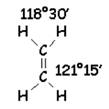
D'autres liaisons non-alcane donnent 120° Exemple pour C2H4
|
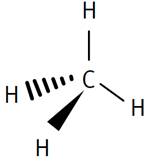
Méthane
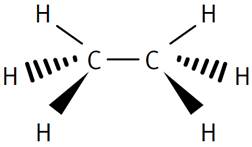
Éthane La configuration géométrique des composés
organiques n'est pas très simple; se reporter aux pages spécialisées de
stéréochimie. |
|
|
||
|
Voir Oxydes
de carbone |
||
|
Hydrocarbures Carbone + Hydrogène |
|
|
|
Nomenclature |
·
composés saturés (alcane) et ·
composés insaturés
(alcènes et alcynes).
·
composés saturés
(cyclane) et ·
composés insaturés
(cyclènes). |
|
|
Cn H2n
+ 2 |
Voir Méthane et grisou / Vache
Suite
en Alcanes et alcools |
|
Alcènes Cn H2n |
|
|
Alcynes Cn H2n
– 2 |
ou
hydrocarbures acétyléniques.
|
|
|
||||
|
Type |
Liaison |
Formule |
Nom |
|
|
Saturés |
1 |
C
H4 |
||
|
|
|
C2
H6 |
Éthane |
|
|
|
|
C3
H8 |
Propane |
|
|
|
|
C4
H10 |
Butane |
|
|
|
|
C5
H12 |
Pentane |
|
|
|
|
C6
H14 |
Hexane |
|
|
|
|
… |
|
|
|
Éthyléniques |
2 |
C2
H4 |
Éthylène |
|
|
Acétyléniques |
3 |
C2
H2 |
Acétylène |
|
|
Cyclaniques |
|
C6
H12 |
Cyclohexane |
|
|
Aromatiques |
|
C6 H6 |
Benzène |
|
|
|
|
C10 H8 |
Naphtalène |
|
Horloge avec formules chimiques

Voir Horloges à cadran mathématique / Noms
des polygones
|
Formule brute: C3H6O
Nom normalisé:
propan-2-one
|
|
Voir Calorie
Source: l'énergie en 2050
|
|
|
|
soit un total de 1080 particules.
|
|
|
|
|
|
Point en 2018 Avec
du graphène, on peut en théorie tirer des câbles jusqu'à la Lune et bâtir un ascenseur spatial. Mais … Malgré
ses propriétés hors-normes, ce dérivé du graphite n'a toujours pas
révolutionné les transports et l'électronique. Malgré
les milliards de dollars investis en Asie, aux États-Unis ou en Europe, la
révolution se fait attendre. Sa
production industrielle ne repose pas encore sur des méthodes fiables
permettant d'obtenir de grosses quantités. On
trouve cependant quelques applications dans l'amélioration des capacités des batteries
(Japon, Espagne) ou le développement de pansements au graphène. (France). Découverte 2019 1,1 ° est l'angle magique de supraconductivité du
graphène. Deux couches superposées de graphène décalées de cet
angle produit un effet de moire et surtout devient supraconducteur ou isolant
selon la tension électrique appliquée à -270 °C |
|
Source 2018: Le
graphène, à un cheveu du miracle? – L'Express 05/11/2018
|
|
|
|
|
|
Voir Ascenseur
|
|
||
|
|
||
|
Chimie organique |
|
|
|
Composés organiques |
||
|
Aliphatiques |
|
|
|
Cycliques |
|
|
|
Aromatiques |
|
|
|
|
|
|
100
millions de degrés: les atomes d'hélium fusionnent pour réaliser la synthèse du
carbone 12. Voir Magnésium
|
|
|
|
|||||||||||||
|
TRANSFORMATION
Datation
Méthode
du carbone 14
|
|||||||||||||
![]()
|
Suite |
|
|
Voir |
|
|
DicoNombre |
|
|
|
|
|
Cette
page |
![]()